PROPÓSITO DEL
BLOQUE II:
BLOQUE II:
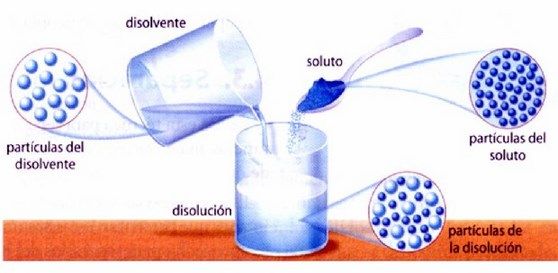
Comprueba la utilidad de los sistemas dispersos en diferentes procesos presentes en su entorno a través de examinar las características distintivas de los mismos y calcula la concentración de las disoluciones.
Competencias genéricas a desarrollar:
- CG 5.6 Utiliza as tecnologías de la información y comunicación para procesar e interpretar información.
- CG 11.1 Asume una actitud que favorece la solución d problemas ambientales en los ámbitos local, nacional e internacional.
Competencias disciplinares básicas a
desarrollar:
·
CDBE 4 Obtiene, registra y sistematiza la
información para responder a preguntas de carácter científico, consultando
fuentes relevantes y realizando experimentos pertinentes.
·
CDBE11 Analiza las leyes generales que rigen
el funcionamiento del medio físico y valora las acciones humanas de impacto
ambiental.
·
CDBE14 Aplica normas de seguridad en el manejo de
sustancias, instrumentos y equipo en la realización de actividades de su vida
cotidiana
Aprendizajes esperados:
§
Ejemplifica
la clasificación de la materia en situaciones de la vida cotidiana.
§
Clasifica
productos de uso cotidiano y sustancias del medio ambiente, de acuerdo al tipo
de sistema disperso al que pertenece.
§
Utiliza
métodos físicos para separar los componentes de mezclas reales e hipotéticas,
relacionándolos con procesos de su vida diaria.
§
Determinar
la concentración de soluciones reales e hipotéticas, valorando su aplicación en
diferentes situaciones de su entorno.
§
Explica
la importancia de conocer el grado de acidez y basicidad de sustancias de uso
común y aquellas relacionadas con el medio ambiente, favoreciendo la toma de decisión
consciente.
Estimados alumnos:
Como es sabido ya por todos ustedes nos enfrentamos a una situación extraordinaria debido a la problemática de salud mundial Covid-19, son momentos en los cuales nos vemos en la necesidad de resolver los problemas a los que nos enfrentamos, de los cuales podemos salir triunfadores, uno de ellos es el avance en los programas educativos, en el desarrollo de sus habilidades que sin duda alguna se que ustedes lo lograrán por el hecho de contar con las herramientas indispensables para demostrar la capacidad autodidacta con la que cuentan y el apoyo que por ahora nosotros sus maestros a través de los medios digitales les iremos dando. Les deseo lo mejor y espero que pronto podamos estar de nuevo en nuestras aulas. Sin más su maestra Luz Gallardo.
ACTIVIDADES A REALIZAR:
BLOQUE II
ACTIVIDAD 1
1. Terminar los ejercicios sobre porcentaje masa y volumen y molaridad de la hoja número 1 entregada en clase.
COLEGIO DE BACHILLERES DEL ESTADO DE CHIHUAHUA
PLANTEL 7
SEMESTRE 2020-A
QUIMICA 2
DOCENTE: ING. LUZ S. GALLARDO ALFARO TURNO
MATUTINO Y VESPERTINO
EJERCICIOS DE CONCENTRACIÓN
Por ciento en peso:
1. Calcula
el por ciento en peso de las siguientes soluciones.
a) 25 gramos de NaBr + 100 gramos de H2O
b) 1.20 gramos de K2SO4 + 10 gramos de
H2O
c) 40 gramos de Mg (NO3)2 + 500 gramos de H2O
d) 60 gramos de NaCl
+ 200 gramos de H2O
2. ¿Cuántos gramos de soluto hay en cada una de las
siguientes soluciones?
a) 30 gramos de AgNO3 b) 0.4 mol de AgNO3
3. ¿Cuánto soluto hay en cada una de las siguientes
soluciones?
a) 65 g de solución de KCl
b) 250 g de solución de K2CrO4 al 15%
c) Las soluciones salinas fisiológicas que se usan en
inyecciones intravenosas tienen una concentración en masa de 9% ¿Cuántos gramos
de NaCl se necesitan para preparar 500 gramos de esta solución.
Por ciento en
volumen:
4. Calcula
el por ciento en volumen de una solución preparada disolviendo:
a) 22.0 mL de CH3OH (alcohol etílico) disueltos
en C2H6OH (alcohol etílico) para dasr 100 mL de solución.
b) 4.2 mL de tolueno disueltos en benceno para completar
12.5 mL de solución.
c) 10 mL de alcohol metílico disueltos en agua hasta
completar 40 mL de solución.
d) 2 mL de CCl4 disueltos en benceno para
completar un volumen de 9.0 mL
e)
¿Qué volumen de
solución alcohólica usual para fricciones al 75% se puede preparar si sólo se
dispone de 160 mL de alcohol isopropílico?
Molaridad
5. Calcula la molaridad de las siguientes soluciones:
a) 0.10 mol de soluto en 250 mL de solución.
b) 2.5 moles de NaCl en .650 l de solución.
c) 0.025 mol de HCl en 10 mL de solución
d) 0.35 mol de BaCl2 en 593 mL de solución.
e) 260g de C11H22O11 en 800
mL de solución.
f) 1.50 g de Al2(SO4)3 en 2
litros de solución.
6. Calcula el número de moles de soluto en cada una de las
siguientes soluciones.
a) 40 mL de LiCl 1.0 M
b) 25 litros de H2SO4
3.0 M
c) 349 mL de NaOH 0.0010 M
d)
5000 mL de CoCl2 3.1 M
7. Calcula los gramos de soluto en cada una de las
siguientes soluciones:
a) 150 L de NaCl 1.0 M
b) 0.035 L de HCl 10.0 M
c) 260 mL de H2SO4 18 M
d) 8.00 mL de Na2CO3. 1.2 M
8. Calcula cuántos mililitros de solución de KCl 0.256 M contendrán lo siguiente:
a) 0.430 mol de KCl
b) 10.0 moles de KCl
c) 20.0 g de KCl
Fuente: López, H.. (2015). QUIMICA 2.
Naucalpan, Edo. de México: ANGLO Digital.
ACTIVIDAD 2
SOLO
LOS GRUPOS QUE NO LA HICIERON EN EL LABORATORIO
COLEGIO
DE BACHILLERES DEL ESTADO DE CHIHUAHUA
QUIMICA II
NOMBRE
DEL ALUMNO _____________________________________ GRUPO ______
Titular
de la materia Ing. Luz S. Gallardo Alfaro SEMESTRE LECTIVO 2020-A
PRACTICA
DE LABORATORIO (PARTE 1)
“Sistemas
dispersos y Concentraciones”
Objetivo:
·
Diferenciar entre disolución, coloide y suspensión
mediante la realización de pruebas de laboratorio que las distingan.
Competencias: CDBE4 Y CDBE 14
Aprendizajes
esperados:
·
Determinar la concentración en soluciones
reales e hipotéticas, valorando su aplicación en diferentes situaciones de su
entorno.
ACTIVIDAD
DE ENTREGA (se puede realizar en computadora).
I.
INTRODUCCIÓN (Sobre los sistemas dispersos y
las concentraciones de las disoluciones
así como su importancia).
II.
OBJETIVO
III.
MATERIALES
IV.
PROCEDIMIENTO
V.
DIAGRAMA DE IMÁGENES O DIBUJOS (MÍNIMO 1 DE
CADA PASO)
VI.
RESULTADO, OBSERVACIONES, PREGUNTAS
RESPONDIDAS Y LA INVESTIGACIÓN QUE SE TE SOLICITA.
VII.
CONCLUSIÓN
Materiales
·
Una cucharadita de sal de mesa
·
Una cucharadita de aceite de cocina
·
Una cucharadita de harina de trigo o de maíz.
·
Alcohol etílico
·
Agua destilada
·
Cuatro tubos de ensayo de aproximadamente 10 ml
PROCEDIMIENTO:
1. Coloquen
en los cuatro tubos de ensayo 3 mL de agua destilada y etiquetarlos del uno al
cuatro.
2. En
el primer tubo adicionen dos pizcas de sal; en el segundo dos mililitros de
aceite; en el tercero dos pizcas de harina y en el cuarto dos mililitros de
alcohol etílico. Agiten muy suavemente cada tubo y observen cada uno de ellos.
¿Esperaban que el aceite se mezclara con el agua? ______________ ¿En cuáles de
ellos se ve el líquido homogéneo? __________________________________ A los
tubos 2 (aceite y agua) y 3 (agua y harina) agítenlos vigorosamente al menos por
tres minutos. Observen los tubos y
describan sus observaciones. Dejen reposar los tubos por cinco minutos y anoten
si hubo cambios.
3. Clasifiquen
cada uno de los tubos de acuerdo a si el sistema es una solución, una
suspensión o un coloide, fundamente su respuesta ¿Esperaban que el aceite se
mezclara con el agua?
4. Para
aplicar lo aprendido, contesten las siguientes preguntas:
5. ¿Cómo
se clasifican los sistemas dispersos? ¿Influye la concentración de las
partículas de la fase dispersa sobre la solubilidad de las disoluciones?
¿Cuáles son las propiedades y características que identifican a un sistema
coloidal?
6. En
la vida cotidiana muchos productos que empleamos se pueden clasificar como
soluciones, suspensiones o coloides.
Apliquen los aprendido investigando 10 ejemplos de soluciones, 10 de
suspensiones y 10 de coloides, incluyendo la importancia que tienen en el área
farmacéutica, industrial o ecológica.
ACTIVIDAD 3
Realizar el reporte de
práctica del experimento llevado a cabo en laboratorio “SEPARACIÓN DE MEZCLAS”. Todo debe ser
realizado en su cuaderno considerando los pasos del método científico
1) INTRODUCCIÓN (Sobre los métodos de separación
de mezclas y referencias citadas así como su importancia).
2) OBJETIVO
3) MATERIALES
4) PROCEDIMIENTO
5) DIAGRAMA DE IMÁGENES O DIBUJOS (MÍNIMO 1 DE
CADA PASO)
6) RESULTADO, OBSERVACIONES, PREGUNTAS Y RESPUESTAS ASÍ COMO LA INVESTIGACIÓN QUE SE TE SOLICITA.
7) CONCLUSIÓN
Fuente: López, H.. (2015). QUIMICA 2. Naucalpan, Edo. de México: ANGLO Digital.
ACTIVIDAD
4
Realizar los problemas
propuestos por nuestro libro de texto que no se hayan realizado en la clase y
de manera autodidacta siguiendo las instrucciones y considerando los vídeos que
se dejan aquí para cada tema responda de manera correcta las páginas:
Página 80 % masa/masa y página 81 % volumen/volumen
Página 83 ppm (partes por millón).
También este te puede ayudar según la fórmula o los datos que te de el problema.
Página 86 Molaridad
o bien pueden considerar el siguiente video para el cálculo de Molaridad
Página 95 El pH (potencial hidrógeno) realizar los ejercicios En acción
Actividades de la página 98
a la 101
De ser necesario vuelve a ver los videos para apoyarte en la realización de los ejercicios a realizar.
ACTIVIDAD
5
PROYECTO
Instrucciones:
En los equipos formados para
las expo-mezclas (no más de 5 integrantes) trabajaran de igual manera en
el proyecto de investigación de la actividad de aprendizaje 5 página 96, se
organizaran de alguna forma ya sea por whatsap, Facebook o correo electrónico y
enviaran el trabajo al correo luzgallardo22@hotmail.com solo se enviará uno por equipo.
El trabajo debe estar
enviado antes del regreso a clases estipulado de manera oficial por las
autoridades académicas. El cuál será revisado en base a una lista de cotejo
considerando los siguientes puntos.
·
De la presentación:
Portada, contenido, limpieza, organización del documento, buena ortografía y
referencias de consulta.
·
Del contenido: Que
sea lo solicitado por la actividad, completo e información relevante.
·
De la entrega: Que
sea entregado en tiempo y forma.
ACTIVIDAD 6
De manera individual realizarán una escala de colores de acuerdo al pH de las sustancias de uso cotidiano, investigando el procedimiento en diversas fuentes de información y cada uno de ustedes considerará acorde para la realización un manejo experimental utilizando lo aprendido en el laboratorio y utilizando instrumentos que tengan en su casa, recuerden que para que sea considerado su proyecto experimental deberá presentar evidencia fotográfica de los procedimientos, de la escala de colores que se obtuvo y usted con su familia realizando el experimento. Esto le servirá como parte de esa convivencia familiar que todos necesitamos en estos días. La entrega para esta parte del proyecto: Reporte de práctica No. 5 con el nombre "Escala de colores del pH en sustancias de uso cotidiano" será en su carpeta, con todos los lineamientos del reporte de práctica ya vistos así como la integración de fotografías, y su contenido.
Antes de elaborar el reporte vuelva a revisar este BLOG ya que aparecerá el instrumento de evaluación de las actividades y productos.
Antes de elaborar el reporte vuelva a revisar este BLOG ya que aparecerá el instrumento de evaluación de las actividades y productos.